酸素とは
酸素(O|Oxygen)は原子番号8、常温25℃で無色無臭の気体で、フッ素に次ぐ電気陰性度の高さで反応性が高く、ミトコンドリアを有する多くの生命体に欠かせない気体です。紫外線や無声放電でオゾンO3にもなり、植物の光合成、助燃性など多種多様な性質を持ちます。
元素「酸素」の詳細

元素の詳細な情報、数値は次の表の通りです。
元素名 (英語) | 酸素 (Oxygen) |
| 原子番号・原子量 | 原子番号8・原子量15.99(約16) |
| 色・相 | 無色・気体 |
融点 沸点 | ー218.4℃ -182.96℃ |
| 電気陰性度 | 3.44 |
| イオン化エネルギー | 第1: 1313.9 kJ/mol 第2: 3388.3 kJ/mol 第3: 5300.5 kJ/mol |
| 同位体 | 12O~28O |
| イオン | O2- |
酸素の物理的性質
同位体では16Oが99.76%で、最多です。酸素は液体だと青みがあり、超高圧下(100万気圧)では金属光沢を持ちます。ものが燃えるのを助ける助燃性があり、全スピン量子数が0で、反磁性、励起状態のものは一重項酸素と呼ばれます。
酸素原子が3つでオゾンO3となり腐食性を持つようになり、地球の大気圏に微量存在しています。安定している酸素の同位体は16O、17O、18Oの3つで、16Oの存在が99%でほとんどです。
酸素の化学的性質
酸素に関係する反応は非常に多く、特に生命維持や生物系で多く見られますが、無機の反応でも同じくらい酸素の存在は不可欠です。酸素の水への溶解度は3.931mg(25℃)、6.945mg(0℃)と温度が低いほうがよく溶けます。
宇宙全体では水素、ヘリウムに次ぐ3番めに多い物質であるとされています。酸素は地球の質量の46.6%を占めています。地球の大気中の酸素の70%は海のシアノバクテリアなどが生成しており、地上の植物はおよそ30%のみの関与です。
【光合成の反応】植物
6CO2 + 6H2O + 日光 → C6H12O6 + 6O2
【酸素の発生|過酸化水素とレバー】
2H2O2 → 2H2O + O2
【酸素の発生|過酸化水素と二酸化マンガン】
2H2O2 + MnO2 → 2H2O + 2O2- + Mn4+ +2O2-
2H2O + 2O2- + Mn4+ +2O2- → 2H2O + MnO2 +O2
※二酸化マンガンと過酸化水素が混ざった状態で、マンガンと酸素が分かれた場合、酸素がイオンの状態で一時的に存在すると考えられます。その後、イオンの状態の酸素は、酸素分子と二酸化マンガンの状態になって安定し、元々あった二酸化マンガンは一度分解して、反応経路の中で再びもとに戻っているように見えます。この時、酸素原子は全くべつの酸素原子になっているでしょうが、二酸化マンガンとしては同じものなので、二酸化マンガンは反応を促進する触媒として作用していると考えられます。レバーなどを利用するよりは再利用可能なので、二酸化マンガンを使用したほうが効率的です。
【銅の酸化】
2Cu + O2 → 2CuO
【マグネシウムの酸化】
2Mg + O2 → 2MgO
【酸化銀の熱分解】
2Ag2O → 4Ag + O2
【酸化鉄ⅡFeOの合成】シュウ酸鉄(II)FeC2O4
FeC2O4 → FeO + CO + CO2
【酸化鉄ⅢFe2O3の合成】赤さび
4Fe3O4 + O2 → 6 αーFe2O3
※空気中で加熱|赤鉄鉱:αーFe2O3
【酸化鉄|酸化鉄(III)鉄(II)|四酸化三鉄Fe3O4の合成】黒さび(磁鉄鉱)
4FeO → Fe + Fe3O4
※酸化鉄Ⅱをゆっくり冷却
3Fe2O3 + H2 → 2Fe3O4 + H2O
3Fe2O3 + CO → 2Fe3O4 + CO2
【ヘモグロビンと酸素】
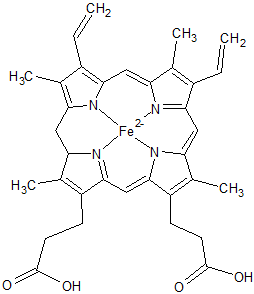
人の血液に含まれているヘモグロビン内にはヘモグロビンのαとβが2つずつ存在して、ヘモグロビン内には4つの上記ヘム鉄部分が含まれています。上記のヘム鉄の中心の鉄と酸素が反応して結合し、酸素を運搬しています。酸素はくっついたり、離れたりできますが、一酸化炭素COは、酸素の200倍ほどこのヘモグロビンと結合しやすいためCOHbとなり、赤血球が酸素の運搬をしなくなります。
高気圧酸素治療を行うと、通常の空気中では300分かかるCO半減期が25分にまで短縮されますが、体中の各組織の酸欠は複合的な損壊を招きます。COが体内で外れて、体内にある酸素原子を一つ奪わないと二酸化炭素にならないため、しばらく酸欠状態が続き、生命維持が難しくなります。これが一酸化炭素中毒の危険性です。
キャンプファイヤーやBBQ、ガスストーブ、長時間のトンネル内自転車or徒歩移動をしていて、耳鳴り、めまい、吐き気、頭痛、眠気を感じたら、その時点で一酸化炭素中毒になっていると考えて、きれいな空気を6時間以上吸わせましょう。緊急の場合には救急対応をしてください。判断できない場合は救急車を即時呼んでください。なってからでは基本的に完治は難しいため、一酸化炭素検知装置などを所持していたほうが安全です。
ヘモグロビンα(HbA)
sp|P01966|2-142
VLSAADKGNVKAAWGKVGGHAAEYGAEALERMFLSFPTTKTYFPHFDLSHGSAQVKGHGA
KVAAALTKAVEHLDDLPGALSELSDLHAHKLRVDPVNFKLLSHSLLVTLASHLPSDFTPA
VHASLDKFLANVSTVLTSKYRhttps://www.uniprot.org/blast/?about=P01966[2-142]&key=Chain&id=PRO_0000052568
ヘモグロビンβ(HbB)
ORIGIN
1 mvhltpeeks avtalwgkvn vdevggealg rllvvypwtq rffesfgdls tpdavmgnpk
61 vkahgkkvlg afsdglahld nlkgtfatls elhcdklhvd penfrllgnv lvcvlahhfg
121 keftppvqaa yqkvvagvan alahkyh












