水素とは
水素(H|Hydrogen)は原子番号1、常温25℃で無色無臭の気体で、元素の中では最も軽い物質です。さまざまな化合物に含まれている重要な元素で、酸化還元、触媒反応の他、現代の化学工業においては、資源としても電源としても欠かせないものです。
元素「水素」の詳細
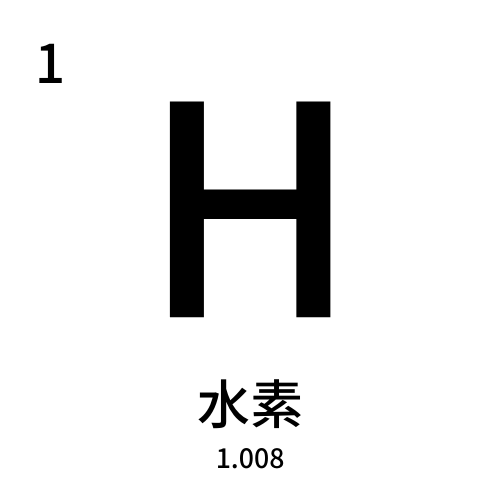
元素の詳細な情報、数値は次の表の通りです。
元素名 (英語) | 水素 (hydrogen) |
| 原子番号・原子量 | 1・1.00794 |
| 色・相 | 無色・気体 |
融点 沸点 | −259.14℃ −252.87℃ |
| 電気陰性度 | 2.20 |
| イオン化エネルギー | 1312.0kJ/mol |
| 同位体 | 重水素・三重水素 |
| イオン | H+ |
水素の物理的性質
水素は、元素の中では最も軽く、宇宙を構成するさまざまな物質に含まれているかなりありふれた元素です。酸素と反応して爆発反応を起こし、水H2Oを生成します。地球上において常温25℃で無色無臭の気体です。
水素の化学的性質
学校で扱う水素の化学反応では、以下のようなものがあります。
【水の合成】
2H2 + O2 → 2H2O
【水の電気分解】電解質、または、以下出典の触媒
2H2O → 2H2 + O2
水を電気分解し続けるマンガン触媒の動作条件を発見
https://www.riken.jp/press/2019/20190319_2/index.html
世界初、可視光を利用して水を分解する酸硫化物光触媒を開発
【アンモニアの合成:ハーバーボッシュ法】触媒:二重促進鉄(Fe3O4ーAl2O3-K2O)
N2 + 3H2 → 2NH3
※25~35MPa・約500℃で反応させる
【メチルアルコールの合成】
CO + 2H2 → CH3OH
【ボルタ電池正極(銅板)】希硫酸
2H+ → 2e– + H2
※電池全体
Zn + 2H+ → Zn2+ + H2
ここでは、水素分子が反応に関わっているものの一部を挙げました。水素原子を1つでも含むものを列挙すると、数千、数万の化学反応式が並ぶことになるため割愛しました。
ヒドリドとは
電気的に陽性なNaBH4やLiAlH4などが電離すると水素の陰イオンH–「ヒドリド」を生じ、塩基、または、還元剤として作用する可能性があります。
【NaBH4の加水分解】
NaBH4 + 2H2O → 4H2 + NaBO4
※厳密には正しい反応式ではない
出典:水素貯蔵材料としての水素化ホウ素ナトリウム
https://www.jstage.jst.go.jp/article/sfj/56/4/56_4_194/_pdf/-char/ja










